Istraživanje na Institutu za molekularnu biologiju i biotehnologiju (IMBB) Fondacije za istraživanje i tehnologiju Hellas (FORTH), objavljeno danas u časopisu Nature Aging, otkriva fundamentalni mehanizam kontrole kvaliteta koji funkcioniše u ćelijama kako bi zaštitio integritet i funkciju jezgro. Održavajući nuklearnu homeostazu, ovaj molekularni mehanizam kritički doprinosi promovisanju dugovečnosti i plodnosti.
Istraživači IMBB dr Margarita-Elena Papandreu i dr Georgios Konstantinidis, na čelu sa dr Nektariosom Tavernarakisom (profesorom na Medicinskom fakultetu Univerziteta na Kritu i predsednikom odbora FORTH), otkrili su da recikliranje nuklearnih i nukleolnih komponenti putem autofagije odlaže starenje somatskih ćelija i održava besmrtnost zametnih ćelija, koje su neophodne za reprodukciju.
Jezgro je centralna organela svih eukariotskih ćelija koja sadrži genetski materijal (DNK), koji određuje ćelijski identitet i funkciju. Tokom starenja iu ćelijama raka, ultrastruktura jezgra se dramatično menja. Štaviše, progresivno i izraženo pogoršanje nuklearne arhitekture je uobičajena i očuvana karakteristika progerije i brojnih drugih poremećaja povezanih sa starenjem.
Pored toga, progeroidni sindromi (npr. Hutchinson-Gilford, Verner, Bloom i Cockaine sindromi, između ostalih), i samo starenje, praćeni su izraženim povećanjem nukleola — najveće dobro definisane strukture unutar jezgra — koja služi kao mesto za generisanje komponenti ribozoma, koji je mašina za sintezu proteina ćelije. Značajno je da je mala veličina nukleola povezana sa dugotrajnošću i intervencijama koje produžavaju život. Međutim, molekularni i ćelijski mehanizmi koji dovode do ovih promena ostali su nejasni. Takođe je nejasno da li su takve promene samo posledica procesa starenja i patologija povezanih sa starenjem, ili imaju uzročnu ulogu u progeriji i opadanju starenja.
Očuvanje nuklearne ultrastrukture i reciklaža nuklearnog materijala je od suštinskog značaja za ćelijsku i homeostazu organizma. Održavanje nuklearne arhitekture i funkcije zahteva kontinuirano i strogo regulisano recikliranje neispravnih ili oštećenih nuklearnih komponenti. Ciljanje i degradacija oštećenih nuklearnih komponenti se vrši nukleofagijom, selektivnim tipom autofagije, koja služi kao mehanizam kontrole kvaliteta nuklearne energije. Zaista, aberantna nukleofagija je umešana u širok spektar patologija, uključujući oštećenje DNK, rak i neurodegeneraciju.
Ipak, nepoznato je učešće autofagnih mehanizama u održavanju strukture i funkcije jezgre tokom starenja. Srodno, nerešeno pitanje odnosi se na signalne puteve i intervencije, kao što su signalizacija insulina/IGF1 i ograničenja u ishrani, koji su dobro okarakterisani modulatori životnog veka, u organizmima u rasponu od nematoda do primata. Nije poznato da li i kako se ovi putevi povezuju sa molekularnim procesima koji oblikuju jezgro i određuju veličinu i funkciju nukleola tokom starenja.
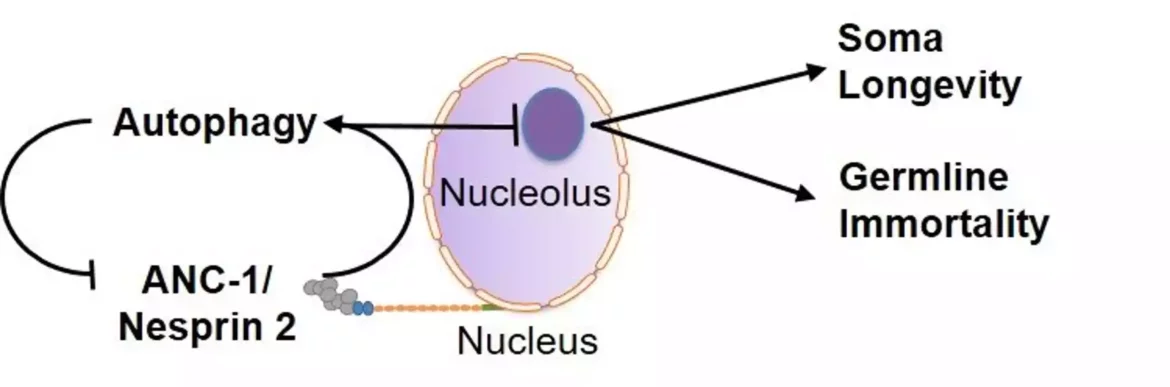
Koristeći dva eksperimentalna organizma, nematodu Caenorhabditis elegans i miša, istraživači IMBB-a su se bavili ovim ključnim pitanjima. U studiji objavljenoj 23. decembra, oni navode da su džinovski nuklearni omotač, sidreni protein, Nesprin-2 i njegov Caenorhabditis elegans ortolog ANC-1 suštinski regulatori nukleofagije.
Nesprin-2/ANC-1 funkcioniše tako da održava malu veličinu nukleola, što je zajednički imenitelj različitih režima produženja životnog veka. Pored toga, Nesprin-2/ANC-1 sprečava abnormalnosti oblika jezgre i akumulaciju Lamina, glavne strukturne komponente nuklearne lamine. Štaviše, uklanjanje aberantnih zametnih ćelija C. elegans tokom njihove diferencijacije, u reproduktivnom sistemu životinje, gonadi, zahteva nukleofagiju posredovanu ANC-1. Zanimljivo je da perturbacija ovog puta klirensa uzrokuje tumorske strukture u zametnoj liniji C. elegans i progresivni sterilitet tokom nekoliko generacija, što je fenomen smrtnosti zametne linije.
Slično, genetsko uništavanje Nesprina 2 kod ženki miševa uzrokuje karcinome jajnika, što ukazuje da su relevantni molekularni putevi evolucijski očuvani, preko udaljenih fila. Zaista, polimorfizmi u humanom homologu nesprina, Sine2, povezani su sa neplodnošću jajnika kod žena. Ovi nalazi pokazuju da je selektivna autofagija nuklearnog materijala važna determinanta somatskog starenja i besmrtnosti zametne linije, u uslovima stresa, i da bi se mogla iskoristiti za lečenje neplodnosti kod ljudi.
„Uvek smo bili intrigirani dihotomijom između dva dijametralno suprotna, fundamentalna fenomena u biologiji: smrtnosti some i besmrtnosti zametne linije. Izgledi da se otkriju molekularne osnove ovog izrazito idiosinkratičnog karaktera tipova ćelija, unutar jednog organizma, pružile su dovoljno motivacije za da krenemo na istraživačko putovanje u pravcu rešavanja takvih pitanja“, rekao je prof. Nektarios Tavernarakis.
„Odlučili smo da se fokusiramo na nuklearnu morfologiju u somatskim ćelijama, koja se pogoršava tokom starenja. Nasuprot tome, celokupna arhitektura jezgra je očuvana u zametnoj liniji. Naša hipoteza je bila da homeostatski mehanizam efikasno održava strukturu jezgra zametnih ćelija, dok ne uspeva tokom starenja, u somi. Iznenadili smo se kada smo otkrili da je autofagna reciklaža nuklearnog materijala važan faktor, koji čuva nuklearnu arhitekturu i ograničava veličinu nukleola. preslušavanje molekularnih mehanizama koji utiču na starenje“,
Nova studija otkriva nukleofagiju kao molekularni mehanizam pomoću kojeg su različiti fiziološki signali integrisani da utiču na nuklearnu arhitekturu i homeostazu. Štaviše, identifikuje nukleofagiju kao nizvodni efektor niske insulinske/IGF1 signalizacije i ograničenja u ishrani na somatsko starenje. Članovi porodice Nesprin služe kao ključni regulatori nukleofagije. Oštećenje recikliranja nuklearnog materijala putem nukleofagije smanjuje otpornost na stres, podriva dugovečnost životinja i pokreće progresivnu smrtnost klica.
Stoga je nukleofagija suštinski mehanizam za dugovečnost some i besmrtnost zametne linije koji promoviše mladost i odlaže starenje u uslovima stresa, očuvanjem nuklearne arhitekture i sprečavanjem nukleolarnog širenja. Čvrsta evoluciona konzervacija i sveprisutno izražavanje uključenih regulatornih faktora ukazuju na to da slični putevi mogu upravljati starenjem kod ljudi.