Tim istraživača iz laboratorije Vang Jangming na Fakultetu za tehnologiju budućnosti Univerziteta u Pekingu nedavno je identifikovao homolog DddA iz Simiaoa sunii (Ddd_Ss) koji može efikasno deaminirati citozin u DC kontekstu u dvolančanoj DNK (dsDNK). Njihovi nalazi su objavljeni 16. februara 2023. u časopisu Nature Communications, pod naslovom „Pretraga homologa DddA i inženjering proširuju kompatibilnost sekvenci uređivanja mitohondrijalne baze“.
Uređivanje baze je precizan način da se uvedu mutacije u ciljnu DNK sekvencu, što je čini korisnim za proučavanje gena i regulatornih elemenata, modeliranje bolesti i razvoj tretmana za genetske bolesti. Dok je uređivanje baze za nuklearnu DNK postignuto kroz grupisane redovno raspoređene kratke palindromske ponavljanja (CRISPR) izvedene uređivače baza, isti pristup nije primenljiv za uređivanje mitohondrijalne DNK (mtDNK) zbog poteškoća u isporuci vodećih RNK u mitohondrije.
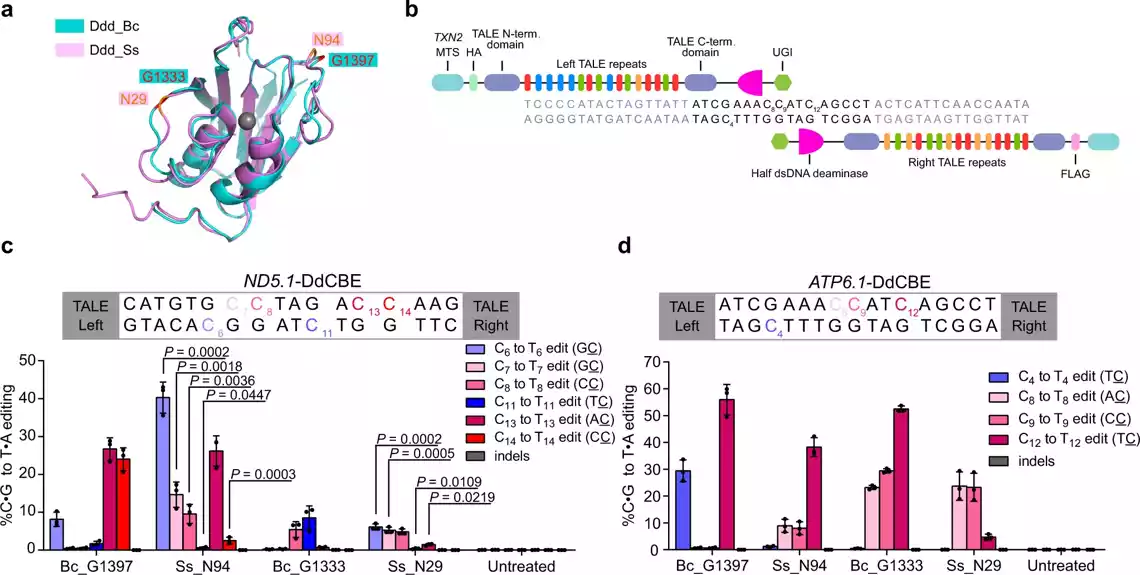
Istraživači su koristili aktivatore poput efektora transkripcije (TALE) izvedene iz uređivača baza DdCBE i TALED da katalizuju C-to-T i A-to-G uređivanje u mtDNK. Ove metode se oslanjaju na DddAtok, dsDNK deaminazu iz bakterije Burkholderia cenocepacia (Ddd_Bc). Međutim, originalni Ddd_Bc zahteva strogi kontekst TC sekvence, što ga čini neprikladnim za ciljeve GC konteksta. Štaviše, nije poznato da li se više dsDNK deaminaza može naći u drugim vrstama.
Da bi rešili ove probleme, istraživači u ovoj studiji su identifikovali i konstruisali homologe dsDNK deaminaze koji bi se mogli koristiti za razvoj visoko efikasnih alata za uređivanje baza. Otkrili su dsDNK deaminazu iz Simiaoa sunii (nazvan po Sun Simiaou, velikom medicinskom naučniku iz Kine u dinastiji Tang (618–907) koja je pokazala visoku aktivnost i široku kompatibilnost sekvenci. Na osnovu ovog otkrića, razvili su visoko efikasne alate za uređivanje baza koji bi mogli da uvedu mutacije na više mtDNK lokusa, uključujući mutacije povezane sa bolešću u prethodno nepristupačnom GC kontekstu.Oni su takođe poboljšali aktivnost i kompatibilnost sekvence DdCBE_Bc uvođenjem jedne aminokiselinske supstitucije iz Ddd_Ss.
Rezultati istraživača su pokazali da C-terminus Ddd_Bc sadrži dva peptidna motiva povezana sa SPKK koji preferiraju vezivanje A/T-bogatih DNK sekvenci u manjem žlebu dsDNK. Brisanjem ovih motiva eliminisana je aktivnost dsDNK deaminaze Ddd_Bc. Međutim, dodavanje AT-kuke, koja ima slično svojstvo vezivanja DNK kao motivi povezani sa SPKK, obnovilo je aktivnost deaminaze skraćenog Ddd_Bc. Mutacija prolina na valin ili asparagin u C-terminalnom peptidu smanjila je ili potpuno ukinula aktivnost deaminaze Ddd_Bc, što ukazuje na važnost motiva povezanog sa SPKK u C-terminusu Ddd_Bc za njegovu aktivnost deaminacije dsDNK.
Ova studija proširuje kompatibilnost sekvenci uređivača mitohondrijalnih baza, ali će u budućnosti biti potrebni sofisticiraniji dizajni da bi se postiglo efikasno i visoko specifično uređivanje.
Mi Li, dr. student na Fakultetu za tehnologiju budućnosti Pekinškog univerziteta, i Ming Ši, doktorat. student Zajedničkog centra za nauku o životu na Univerzitetu Peking-Tsinghua, su prvi autori rada. Studiju su vodile i pomagale laboratorije Ji Chengkija, Gao Ninga, Vei Venshenga, Cheng Hepinga, Vang Ksianhua i Chen Liangiija na Univerzitetu u Pekingu. Podneta je i prijava za patent za novootkrivenu prijavu vezanu za dvolančanu deaminazu.