Mesindžer RNK (mRNA) sadrži hemijske oznake koje su kritične za antivirusnu odbranu u ćelijama, prema novoj studiji istraživača iz Veill Cornell Medicine. Ovo otkriće rešava 50-godišnju misteriju u vezi sa svrhom ovih hemijskih modifikacija i sugeriše da pogrešna modifikacija mRNA može biti osnova nekih autoimunih i inflamatornih poremećaja.
Istraživači, čiji se nalazi pojavljuju 1. februara u časopisu Nature, otkrili su da prisustvo uobičajene modifikacije, nazvane metilacija, na određenom mestu na molekulu iRNK, pruža dodatnu zaštitu iRNK od antivirusnih imunoloških mehanizama koji bi je inače mogli uništiti.
„Znali smo još od 1970-ih da su metil modifikacije na neki način fundamentalne za to kako mRNK normalno funkcionišu“, rekao je stariji autor studije dr Samie Jaffrei, Greenberg-Starr profesor na odeljenju za farmakologiju u Veill Cornell Medicine. „Tako da je veoma drago što konačno imamo ovaj uvid u njegovu preciznu ulogu.
Mesindžerske RNK se kopiraju iz aktivnih gena i nazivaju se glasnicima jer prenose uputstva za stvaranje proteina iz DNK u ćelijskom jezgru ka spolja u glavni deo ćelija — citosol — gde se prevode u proteine.
Laboratorija Jaffrei istražuje mehanizme koje ćelije koriste da regulišu mesindžer RNK – na primer, da pojačaju ili inhibiraju njihovo prevođenje u proteine. Jedna vrsta regulacije uključuje ugrađivanje hemijskih modifikacija u iRNK. Ove hemijske modifikacije obično uključuju metil modifikacije.
U prethodnom radu, Džefrijeva grupa je razvila metode za otkrivanje jedne od ovih metil modifikacija, nazvanih metil adenozin ili m6A, koja kontroliše stabilnost mRNK u ćelijama. Promene u m6A mogu dovesti do različitih vrsta raka.
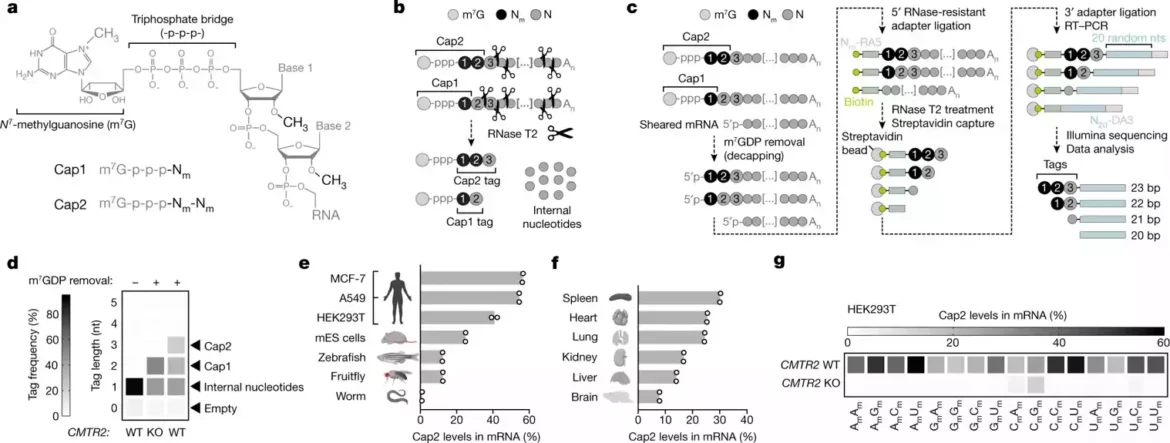
Međutim, mRNK često sadrže još jednu hemijsku modifikaciju pod nazivom Cap 2. U svojoj novoj studiji, Jaffrei i prvi autor Vladimir Despić, postdoktorski naučni saradnik u laboratoriji, ispitali su ovu modifikaciju čija je funkcija bila trajna misterija.
IRNK, kao i DNK iz koje je kopirana, je lanac malih molekularnih građevinskih blokova koji se nazivaju nukleotidi. Kada se napravi mRNK, ona je „zatvorena“ na svom prvom nukleotidu malim organskim molekulom. Prvi nukleotid je takođe modifikovan vezivanjem malog klastera atoma koji se zove metil grupa.
Kada je ova vrsta metilacije prisutna na prvom nukleotidu, kaže se da mRNA ima standardnu kapicu „Cap1“, za koju se zna da pomaže u zaštiti iRNK od imunoloških mehanizama koji kontrolišu citosol za bilo šta što liči na virusnu RNK.
Intrigantno, neke mRNK dobijaju dodatnu metilaciju na svom drugom nukleotidu. Zašto dolazi do ove dodatne „Cap2“ metilacije i zašto se ona vidi na nekim mRNK, a ne na drugim, pitanja su na koja je praktično nemoguće odgovoriti – uglavnom zato što biolozi nisu imali dobar metod za otkrivanje koje mRNK imaju Cap2 u odnosu na Cap1.
Jaffrei i Despic su započeli svoju studiju razvijanjem upravo takve metode, koju nazivaju CLAM-Cap-sek. Sa njim su otkrili da se metilacija Cap2 može desiti na bilo kojoj mRNK, ali se dešava relativno sporo, tako da ima tendenciju da se nađe samo na mRNK koje su u citosolu duže vremenske periode.
Na kraju, pronašli su dokaze da dok Cap1 u velikoj meri smanjuje sposobnost mRNK da pokrene ćelijske antivirusne mehanizme, Cap2 pruža ključnu dodatnu zaštitu. Istraživači su primetili da kada su mRNK ćelije samo tipa Cap1, ove ćelijske mRNK aktiviraju inflamatorne antivirusne mehanizme ćelija, čak i u odsustvu virusa.
Ali previše Cap2 je takođe loše, otkrili su istraživači. Kada su konstruisali ćelije da brzo inkorporiraju Cap2 u mRNA, otkrili su da su RNK invazivnih virusa počele da ga dobijaju, štiteći ih od imunološkog napada i dozvoljavajući virusima da izmiču kontroli.
„Mislimo da se metilacija Cap2 odvija sporo, a ne brzo, kako bi se smanjila mogućnost da će završiti prikrivanjem virusnih RNK koje se brzo repliciraju“, rekao je Jaffrei.
Nalazi, osim što rešavaju dugogodišnju misteriju Cap2, otvaraju nove pravce za translaciona istraživanja. Jedna od mogućnosti koju dr Džefri sada pokušava, rekao je, jeste da disfunkcija Cap1/Cap2 procesa leži u osnovi nekih uobičajenih inflamatornih i autoimunih poremećaja, kao što su lupus i reumatoidni artritis, i da bi ispravljanje ove disfunkcije moglo biti novi način lečenja ovih poremećaji.
Druga mogućnost, rekao je on, je da se pojača antivirusni imunitet inhibicijom Cap2 u kontekstu virusnih infekcija koje inače nemaju dobar tretman.
„Takođe proučavamo mogućnost korišćenja modifikacija Cap2“, rekao je Jaffrei, „da bismo poboljšali terapiju zasnovanu na mRNK, uključujući vakcine, smanjenjem njihovih inflamatornih efekata u ćelijama“.